Introducción: el catalizador de FCC.
Historia del proceso de FCC
El proceso de Craqueo Catalítico Fluido (FCC) es sin duda el corazón de la refinería y puede ser considerado uno de los más importantes procesos de la Industria Química. Este proceso convierte residuos atmosféricos pesados y destilados de vacío en fracciones más valoradas tales como gasolina, diesel, queroseno y GLP.
Al inicio del siglo 19, las lámparas para iluminación interna muchas veces utilizaban aceite de ballena como combustible. Iluminantes a base de petróleo tales como lampiones comenzaron a sustituir el aceite de ballena en torno a 1850, dando origen a una industria emergente que producía queroseno a partir del refino de aceite crudo. Alrededor del fin del siglo la industria automotiva, en crecimiento, propició un uso alternativo a fracciones ligeras de petróleo, principalmente gasolina. Luego el suministro de gasolina de destilación directa como combustible para motores automotivos se volvió insuficiente. Por esta razón, la industria del petróleo empezó a buscar procesos alternativos objetivando aumentar la producción de fracciones más ligeras. Este hecho fue la fuerza motriz para el primer proceso de craqueo, el Craqueo Térmico1. El proceso de craqueo térmico (también conocido como “proceso de craqueo Shukhov”) fue inventado por el ingeniero ruso Vladimir Shukhov y patentado en 1891 en el Imperio Ruso, patente n° 12926, el 27 de noviembre de 1891. Más tarde, este proceso fue modificado por el ingeniero estadounidense William Merriam Burton y patentado como patente norteamericana U.S. 1.049.667 el 8 de junio de 1908.
A medida que motores más nuevos y más potentes fueron siendo desarrollados, fue exigida gasolina de octanaje más alto. Además de eso, motores de avión necesitaban combustible con índices de octanas próximos de 100. Tales características no podrían ser obtenidas a través del proceso tradicional de craqueo térmico. Por lo tanto, el descubrimiento de un proceso de craqueo más eficiente, por el ingeniero francés Eugene Houdry2 en los años 1920, permitió que las refinerías produjesen gasolina de octanaje más elevado, permitiendo igualmente un aumento en el suministro de la misma. Este proceso fue denominado Craqueo Catalítico (conocido como “craqueo catalítico de lecho fijo de Houdry”), ya que reacciones de craqueo eran promovidas por un catalizador sólido3. El proceso comprendía varios reactores separados actuando como un proceso cíclico, o mejor, mientras que en algunos reactores ocurría craqueo, en otros el catalizador sufría regeneración por quema de coque con aire. El concepto de craqueo térmico fue perfeccionado adicionalmente por el Craqueo Catalítico Thermofor de Mobil (TCC), en el cual un lecho móvil de catalizador con un macrocatalizador (esferas con diámetro de 1,5-2mm) era usado. El sistema de lecho móvil aumentó el rendimiento de gasolina en 15% en relación al sistema de lecho fijo.
El conocimiento sobre lechos fluidizados junto con la preparación de catalizador en partículas finas fue la base para el desarrollo del proceso de Craqueo Catalítico Fluido (FCC)5,6. El uso de partículas pequeñas ofrecía ventajas en términos de transferencia de calor y difusión de masa en relación a las grandes pelotas de catalizador usadas tanto en lecho fijo como en TCC. La primera unidad de FCC empezó en mayo de 1942, en la refinería de Standard Oil de New Jersey en Baton Rouge, Louisiana. La enorme demanda por combustibles para motor y aviación debido a la 2ª Guerra Mundial ayudó a establecer este proceso. En verdad, entre 1942 y 1945, 34 nuevas unidades fueron puestas en marcha.
El perfeccionamiento de la tecnología de FCC fue efectuado a través de varios tipos de reactores. De hecho, el primero fue un reactor de flujo ascendente Modelo I FCC, seguido por el reactor de flujo descendente Modelo II FCC. Fueron igualmente desarrollados el proyecto de reactor empilhado, Ese modelo 4 y el riser recto. Por fin, el proyecto lado a lado con riser recto, mejor para unidades grandes, fue comercializado en 1950.
El catalizador de FCC
El primer uso comercial de craqueo catalítico ocurrió en 1915 cuando A. M. McAfee desarrolló un proceso en batelada usando cloruro de aluminio (que era un catalizador tradicional de Friedel Crafts conocido desde 1877) para promover el craqueo de petróleos pesados. Sin embargo, el coste prohibitivo del catalizador impidió el uso generalizado del proceso de McAfee en esa época.
Los catalizadores para craqueo son históricamente subdivididos en los tres siguientes principales grupos:
- Catalizadores Naturales – arcillas, como bentonita o montmorillonita, eran sometidas a tratamiento ácido para remover Na y Mg y aumentar su acidez;
- Catalizadores amorfos – estos eran geles de sílica y alúmina, resultantes de la reacción de Na2SiO3 y Al2(SO4)3. Había dos tipos de esos catalizadores, baja alúmina (10 a 15% de Al2O3) y alta alúmina (20 a 30% de Al2O3);
- Catalizadores cristalinos – Microesferas (40-150 µm), teniendo como componente principal una zeolita cristalina.
En realidad, Houdry fue el primero a usar las bentonitas tratadas con ácido como catalizadores de craqueo, ya en 1936. En los años 1940, catalizadores de sílica-alúmina fueron sintetizados y perfeccionaron grandemente el desempeño de catalizadores a base de arcilla. Los primeros catalizadores sintéticos amorfos de sílica-alúmina contenían cerca de 13% en peso de Al2O3 (baja alúmina), sin embargo, en 1955, el tenor de Al2O3 había sido elevado para cerca del 25%.
En 1962 ocurrió la innovación catalítica más importante del proceso de FCC, cuando un componente, conocido como Zeolita-Y, fue adicionado al catalizador activo de alúmina. Fue verificado que a través de la adición de pequeñas proporciones de zeolita en la matriz del catalizador antiguo de sílica-alúmina, había sido producido un nuevo catalizador. Ese catalizador tenía un desempeño excelente, mucho mejor que el de cualquier catalizador anterior. El catalizador zeolítico mejoró mucho el rendimiento en gasolina (Tabla 1). Los primeros catalizadores zeolíticos comerciales fueron introducidos en 1964, y los catalizadores zeolíticos continúan siendo usados actualmente.
Sin embargo, se debe tener en mente que la gasolina producida vía los catalizadores zeolíticos originales tenía un Número de Octanas Investigación (RON) más bajo. Esto fue correlacionado posteriormente con el hecho de que zeolitas, teniendo una densidad muy elevada em sitios ácidos, estaban aumentando la Reacción de Transferencia de Hidrógeno (HTR) como descrito abajo.
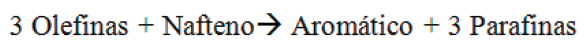

Esa reacción es perjudicial a la calidad de la gasolina cuando se trata de RON. Por esta razón las zeolitas sufrieron varios tipos de modificaciones con el objetivo de reducir la transferencia de hidrógeno, aumentando así el RON de la gasolina.
Aunque un elevado número de formulaciones pueda ser encontrado actualmente cuando se trata de catalizadores de FCC, para cualquier formulación los componentes del catalizador pueden ser clasificados como abajo8:
[a] COMPONENTE ACTIVO – responsable por la mayor parte de la actividad del catalizador, constituido en general por faujasitas (o zeolitas-Y). Actualmente, otra zeolita ha sido usada (ZSM-5).
[b] MATRICES – estas promueven conversión de fondos, aumentando la actividad global del catalizador. Necesitan tener cierta tolerancia a Ni y V, a compuestos nitrogenados y, cuando posible promover efectos DESOX. También deben tener propiedades ligantes.
- Matriz activa – normalmente, la matriz activa es una alúmina9, que es ácida, aunque menos ácida que la zeolita, y por otro lado, alúminas tienen poros mucho mayores que la zeolita, por lo tanto estas promuevem el pre craqueo de moléculas más pesadas;
- Matriz inerte – normalmente, la matriz inerte es una arcilla, como caolín, siendo usada para conferir propiedades físicas;
- Matriz sintética – la matriz sintética es en realidad un ligante que mantiene todos los otros componentes ligados en el catalizador final.
[d] INGREDIENTES FUNCIONALES – ingredientes adicionados al catalizador para desempeñar una función específica (esto es, trampas para capturar compuestos de Vanadio).
Los catalizadores de FCC están en constante modificación, nuevos catalizadores comerciales siendo entregados al mercado a cada seis meses o menos. En verdad, nuevas formulaciones están siendo desarrolladas constantemente, objetivando:
- Desfavorecer la formación de coque;
- Promover la conversión de fondos;
- Presentar alta resistencia a metales (V, Ni y Fe);
- Exhibir desempeño excelente en términos de octanas, ya que compuestos conteniendo plomo no pueden más ser usados.
La preparación de catalizadores de FCC
Como mencionado anteriormente, los catalizadores de FCC son especies multicomponentes, cuya preparación no es trivial. El tipo de componente usado, los ingredientes usados en la preparación de los mismos, el orden de adición de estos ingredientes y como responden a la calcinación bajo vapor determinarán las características finales del catalizador. Aunque diferentes tecnologías puedan tener diferentes etapas en la preparación del catalizador, las etapas convencionales pueden ser didácticamente divididas en:
a) Preparación de la Zeolita;
b) Modificaciones de la Zeolita;
c) Formación de la Partícula (por secado por atomización o spray drying);
d) Intercambio Iónico;
e) Lavado;
f) Secado;
g) Calcinación.
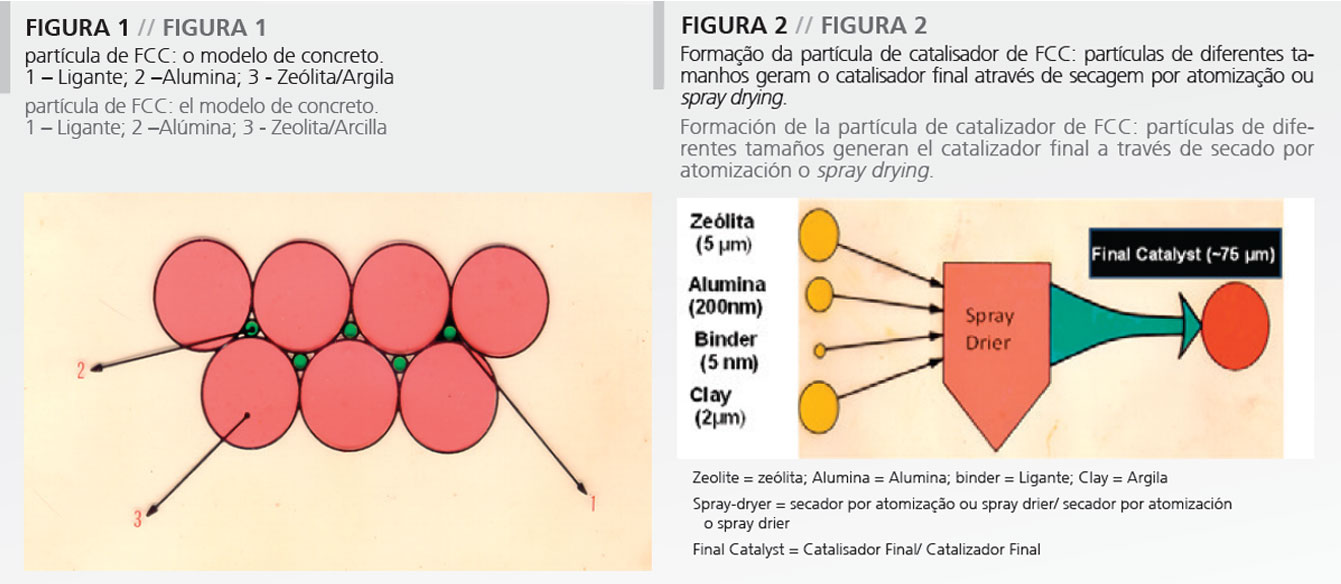
En verdad, la partícula de catalizador de FCC es muy similar a una partícula de concreto. El concreto es un material de construcción compósito compuesto primariamente de grava, cemento y arena, cuyos tamaños relativos son 15, 250 y 5000. En relación a la partícula de catalizador, se tiene un ligante, alúmina y zeolita/arcilla, que tienen aproximadamente los mismos tamaños relativos (Figura 1), formando una partícula de considerable dureza.
Como demostrado en la Figura 2, los diferentes componentes, isto é, la alúmina, la zeolita y la arcilla son básicamente polvos que tienen diferentes tamaños medios de partícula. Estos son en general colocados en suspensión en un frasco, junto con el ligante, en general producido in situ. Después de efectuar la suspensión de todos los componentes, es necesario formar la partícula de catalizador. La formación de la partícula requiere el uso de una tecnología cualquiera de formación de partícula. Normalmente, es escogido el secado por atomización o spray drying ya que esta puede proveer el productor con una distribución relativamente estrecha de tamaño de partícula y buena resistencia a la fricción, que es una de las mayores preocupaciones en el desempeño del catalizador de FCC (Figura 2). Adicionalmente, muchas tecnologías exigen una etapa final de calcinación con el fin de aumentar la dureza del catalizador. Sin embargo, la calcinación debe ser efectuada con cuidado, ya que el componente zeolita es muy sensible a la calcinación por vapor.
El componente zeolita
a) Estabilidad Térmica: Por cierto, una de las razones más importantes para basar la selección de zeolitas como catalizador para reacciones a alta temperatura es su buena estabilidad térmica. La mayor parte de las zeolitas no es afectada por temperaturas de hasta 650°C. Para zeolitas que presentan altas razones sílica-alúmina, el colapso estructural se vuelve significativo solamente a temperaturas tan elevadas como 1000°C. Además de eso, la introducción de átomos Tierras Raras en la zeolita también aumenta la estabilidad térmica. Por lo tanto, esas zeolitas son adecuadas para procesos de craqueo catalítico fluido, donde prevalecen altas temperaturas y otras condiciones operacionales agresivas.
b) Acidez: Zeolitas exiben acidez mucho más alta que los primeros catalizadores amorfos de sílica-alúmina. Además de eso, las zeolitas tienen sitios ácidos tanto de Brönsted como de Lewis. La densidad de esos sitios ácidos está correlacionada a la razón sílica-alúmina (SAR) en la estructura zeolítica. Esa densidad aumenta con el tenor de aluminio. Sin embargo, a medida que la SAR aumenta y la densidad de sitios disminuye, la fuerza de sitios aislados aumenta, alcanzando un máximo. En general, los siguientes parámetros afectan la acidez de una zeolita:
1. La naturaleza y tipo de los sitios ácidos
2. La densidad o concentración de los sitios ácidos
3. La distribución de fuerza de los sitios ácidos
4. La localización de los sitios ácidos en el interior de la estructura zeolítica
5. La distribución geométrica de los sitios ácidos sobre los cristales de zeolita.
Un parámetro importante que gobierna la acidez por unidad de célula en la estructura zeolítica es el Tamaño de Célula Unitaria (UCS), representado por el símbolo A0. El valor de A0 está relacionado a la SAR de la zeolita.
c) Selectividad de forma 10,11,12: Las dimensiones de los poros en el interior de la estructura zeolítica son muchas veces similares a los tamaños de las moléculas que participan en las reacciones que estas catalizan, generando una fuerte influencia en la selectividad de estas reacciones. Los principales tipos de selectividad son los siguientes:
- Selectividad del reactivo ocurre cuando solamente parte de las moléculas reactivas son suficientemente pequeñas para difundir a través de los poros del catalizador.
- Selectividad del producto ocurre cuando parte de los productos formados en el interior de los poros son excesivamente voluminosos para difundir bajo forma de productos observados. Estos son convertidos o en moléculas menos voluminosas o eventualmente desactivan el catalizador por el bloqueo de poros.
- Selectividad restricta del estado de transición ocurre cuando ciertas reacciones son impedidas porque el estado de transición correspondiente exigiría más espacio que aquel disponible en las cavidades. Ni el reactivo ni las moléculas potenciales de producto son impedidos de difundir a través de los poros. Las reacciones que necesitan estados de transición más bajos ocurren sin impedimento.
- Control de tráfico molecular puede ocurrir en zeolitas con más de un tipo de sistema de poro. Aquí las moléculas de reactivo pueden entrar preferencialmente en el catalizador a través de uno de los sistemas de poro mientras los productos difunden a través del otro sistema de poro.
d) Efectos de Concentración: Efectos de concentración están relacionados a los conceptos de hidrofilicidad o hidrofilicidad de las zeolitas, afectando la selectividad de la reacción. Esas propiedades pueden tener un ajuste fino cuando las zeolitas están siendo sintetizadas, produciendo zeolitas específicas para cierta finalidad.
Como mencionado anteriormente, el componente zeolítico es el componente más importante en el catalizador de FCC, siendo capaz de proveer el catalizador tanto con la acidez como con la selectividad conveniente. En catalizadores de FCC, la zeolita empleada es faujasita, o antes, la estructura FAU. La razón Si/Al de la zeolita-Y preparada es una característica importante de ese material ya que cuanto más alta la razón Si/Al, más estable es la zeolita en relación a desaluminización ácida e hidrotérmica.
La zeolita es sintetizada en la forma sódica, que es una forma no-activa, ya que los sitios ácidos (sitios ácidos de Brönsted) responsables por la formación de carbocationes y por lo tanto reacciones de craqueo no están presentes. Así, la zeolita NaY debe sufrir intercambio iónico con amonio (o iones Tierras Raras) para preparar la forma amonio/TR de la zeolita que dará origen a la forma ácida HY por calcinación.
Zeolitas REY
La introducción de ELEMENTOS TIERRAS RARAS en el componente zeolítico, vía intercambio iónico, seguida de una etapa de calcinación, es una de las más importantes modificaciones efectuadas en el proceso de preparación de catalizadores de FCC, ya que esta aumenta tanto la estabilidad de la zeolita como la actividad general del catalizador9. Además de eso, la calcinación promueve la desaluminización de la estructura, cambiando las características de acidez y de textura de la zeolita.
Zeolitas con tenores elevados de La y Ce, que fueron calcinadas en presencia de vapor o no, fueron estudiadas usando el refinamiento de estructura de Rietveld13. Como representado en la Figura 3, varios sitios cristalográficos pueden ser encontrados en la estructura de la zeolita-Y.
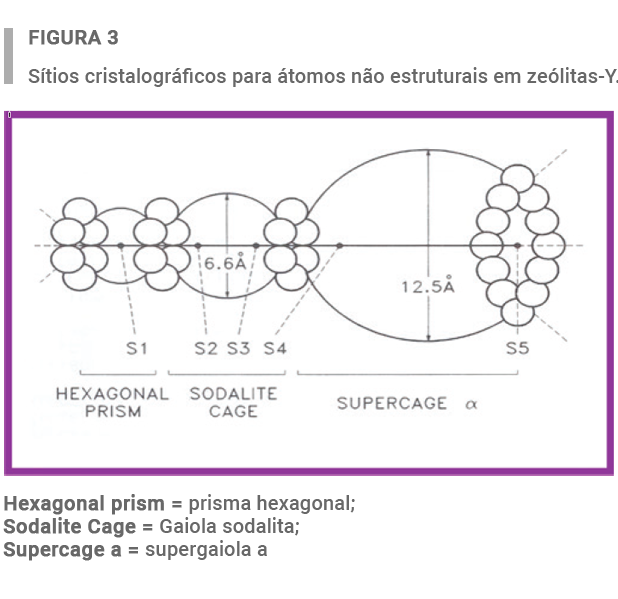
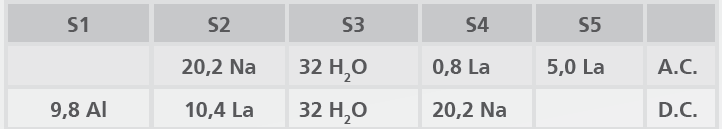
Los resultados de la Tabla 2 muestran que:
- Después del intercambio iónico, TR son localizadas en los sitios 4 y 5 en la supercaja;
- Sin embargo, después de la calcinación, ocurre migración para la caja sodalita y prisma hexagonal;
- Esa migración ocurre no importa el tipo de átomo TR (La o Ce)
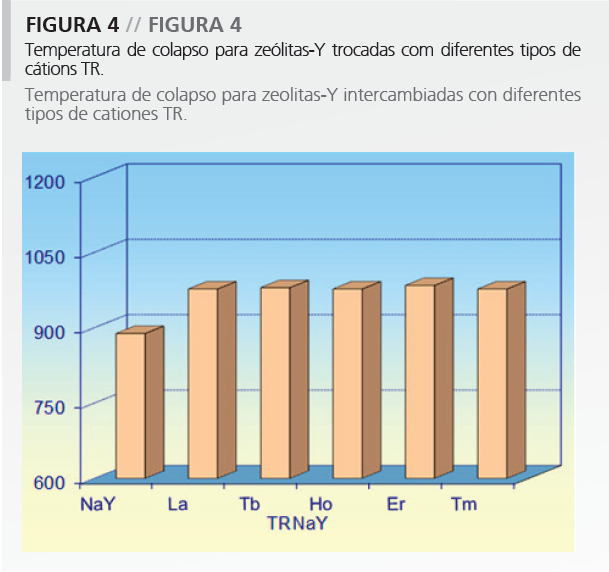
Además de eso, 27Al-MAS/NMR confirma que por calcinación está ocurriendo desaluminización; sin embargo, no es observado el colapso de la estructura. De modo interesante, como relatado anteriormente14, la temperatura de colapso de la estructura aumenta con la introducción de TR, no importando el tipo de catión TR introducido (Figura 4).
Otra cuestión importante es relativa a la acidez de zeolitas-Y conteniendo TR. Estudios 15 con zeolitas con el mismo tenor de diferentes cationes (La, Nd, Sm, Gd, Dy) verificaron que el rayo iónico del catión representa un papel importante en la formación de sitios ácidos de Brönsted.
El espectro de IR (región del OH) muestra claramente que la introducción de TR genera una banda entre 3490-3530 cm-1 (OH interaccionando con TR). Esa banda sufre un desplazamiento para números de onda más altos a la medida que el rayo iónico aumenta.
Algunas conclusiones muy interesantes se pueden sacar de esta serie de experimentos y caracterización. De hecho, por calcinación, las TR realmente emigran para sitios más internos. Una vez posicionados en el interior de la caja sodalita y el prisma hexagonal, son formados grupos TR-O-TR. Esos grupos tienen capacidad para estabilizar la estructura zeolítica a través de la generación de puentes con los átomos de oxígeno de la misma. Además de eso, el grado de estabilización depende del grado de intercambio de TR (Figura 6).
En relación a la acidez, cationes TR(H2O)n sufren hidrólisis por calcinación, generando sitios ácidos de Brönsted. Esa reacción de hidrólisis permite que sea explicada la concentración de sitios ácidos más elevada en zeolitas TRYC (TR-Y Calcinadas) y su actividad más alta. Los sitios de Brönsted parecen ser una función del tipo de cationes TR introducidos en la zeolita.
Una otra cuestión importante dice a respecto a la actividad. Artículos publicados anteriormente también mostraron, usando el craqueo de n-heptano como molécula sonda:
- Actividad depende del grado de intercambio iónico;
- Un máximo es alcanzado para 40% de intercambio con Na;
- Aparentemente las siguientes reacciones están ocurriendo:
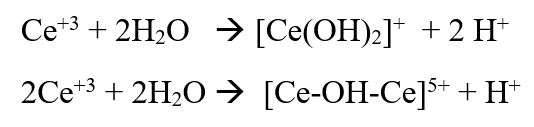
Estas reacciones explican porque una actividad máxima es alcanzada dependiendo del grado de intercambio. Sin embargo, esa actividad máxima depende tanto del tipo de catión TR como del tipo de reacción modelo.
En términos de craqueo, la presencia de TR en la zeolita afecta la capacidad de transferencia de hidrógeno. La reacción de Transferencia de Hidrógeno (HT), en el proceso de FCC, es muy importante ya que:
- Esta compite con otras reacciones importantes como el propio craqueo, isomerización y alquilación;
- Esta transforma olefinas en parafinas, reduciendo el RON de la gasolina;
- Esta es por lo tanto determinante para la selectividad del proceso.
La presencia de TR aumenta la acidez de Brönsted, por lo tanto TR afectan tanto la actividad como la selectividad. Cuanto mayor el rayo iónico del átomo de TR, más alta la acidez generada en la zeolita. Ya que HT aumenta con la acidez aumentada de la zeolita, cuanto más alto el rayo atômico del átomo de TR, más elevada será la HT. En geral, TR favorece HT, reduciendo RON por la reducción de la concentración de olefinas en la gasolina. Sin embargo, ya que TR también afectan la estabilidad de la zeolita, a veces la evaluación puede ser equivocada. Igualmente, es necesario tener en mente que los resultados industriales muestran que TR parecen tener poca influencia sobre el MON de la gasolina. Finalmente, vale la pena mencionar que Tierras Raras también tienen un papel importante en la prevención de la desactivación de metales ya que estas constituyen una trampa muy eficiente para Vanadio.
Conclusiones
Elementos Tierras Raras constituyen de hecho un componente muy importante de los catalizadores de FCC. Sin embargo, Tierras Raras están enfrentando un problema terrible de aumento de precio y reducción de disponibilidad10. Así, ha sido investigada la remoción de estos ingredientes de la composición de catalizador de FCC. Sin embargo, la remoción total de elementos Tierras Raras del componente zeolítico de un catalizador de FCC resultaría en un efecto detrimental considerable en la mayor parte de las operaciones de FCC debido a la actividad más baja y volumen empeorado de rendimiento de producción, para no hablar en el problema de mayor desactivación por Vanadio.
Por esta razón, otros elementos como Ca y Cr fueron ensayados, sin resultados animadores.
Recientemente, productores (Catalysts Technologies) anunciaron la comercialización bien sucedida de Catalizador para FCC con Cero/Bajo Tenor de Tierras Raras. Se debe tener en mente que algunas características especiales relativas a este catalizador deben estar presentes, tales como:
- Proporciones muy altas de matrix selectiva;
- Alta accesibilidad;
- Altos niveles de zeolita para actividad aumentada;
- Alta razón sílica-alúmina (SAR), que resulta en estabilidad superior de la zeolita;
- Cargas de bajo tenor de Vanadio.




































¿Qué le pareció la publicación?
Comentários (1)